Electron hóa trị là vấn đề quan trọng và được quan tâm trong chương trình hóa học Trung học phổ thông. Vậy electron hóa trị là gì? Cách xác định số electron hóa trị như nào? Cùng Dinhnghia.com.vn tìm hiểu electron hóa trị là gì trong bài viết cụ thể dưới đây!
Electron hóa trị là gì?
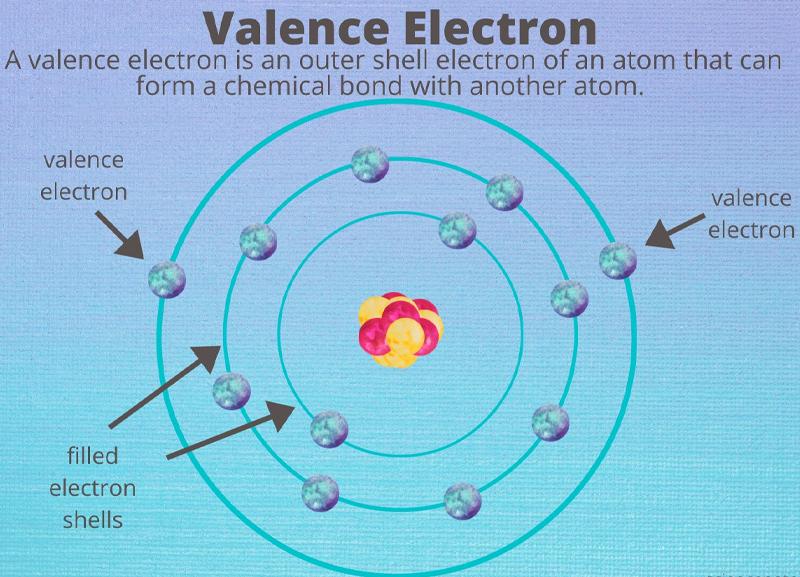
Electron hóa trị hay electron ngoài cùng (Valence Electron) là những electron ở các orbital của lớp vỏ ngoài cùng nguyên tử và có thể tham gia hình thành các liên kết của nguyên tử. Electron hóa trị các nguyên tố nhóm chính nằm ở lớp ngoài cùng, còn trong nhóm nguyên tố nhóm phụ (kim loại chuyển tiếp) electron hóa trị có tại lớp vỏ bên trong.
Electron hóa trị của các nguyên tố có thể tham gia vào liên kết của nguyên tử (gọi là electron liên kết) nhưng cũng có thể không. Nói cách khác số electron hóa trị của một nguyên tố cho biết số electron tối đa có thể tham gia liên kết của nguyên tử nguyên tố đó.
Ví dụ 1:
Nguyên tử Natri (Na) có cấu hình electron là 1s² 2s² 2p⁶ 3s¹
- Lớp ngoài cùng: 3s¹
- Số electron hóa trị: 1
Trong lớp ngoài cùng, có 1 electron trong lớp 3s, vì vậy số electron hóa trị của nguyên tử natri là 1.
Ví dụ 2:
Nguyên tử Lưu huỳnh (S) có cấu hình electron là 1s² 2s² 2p⁶ 3s² 3p⁴
- Lớp ngoài cùng: 3s² 3p⁴
- Số electron hóa trị: 6
Trong lớp ngoài cùng, có 6 electron trong lớp 3s và 3p, vì vậy số electron hóa trị của nguyên tử lưu huỳnh là 6.
Đặc điểm của electron hóa trị
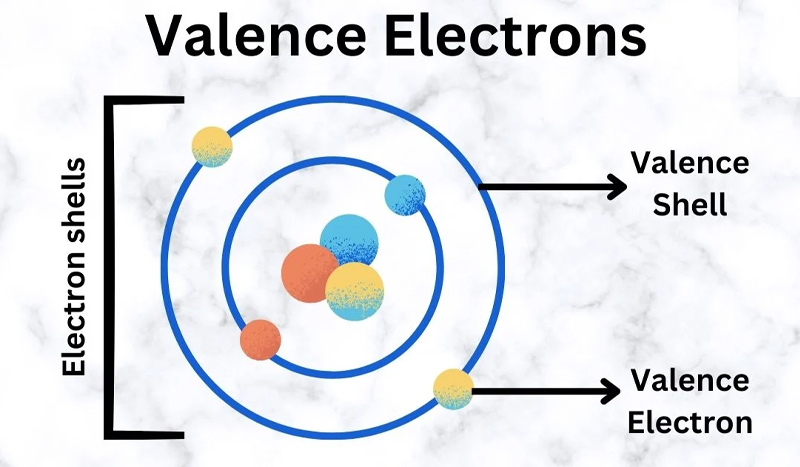
Electron hóa trị là những electron có mặt trong lớp ngoài cùng của cấu trúc electron của một nguyên tử, đóng vai trò quan trọng trong các phản ứng hóa học và tạo liên kết giữa các nguyên tử để tạo thành các hợp chất. Các đặc điểm chính của electron hóa trị:
- Electron hóa trị là số electron có sẵn trong orbital của lớp ngoài cùng của một nguyên tử, có khả năng tham gia vào các liên kết hóa học và các phản ứng hóa học. Các electron hóa trị nằm trong các orbital của lớp ngoài cùng và quyết định tính chất hóa học của nguyên tử.
- Số electron hóa trị của nguyên tử được xác định bằng số thứ tự nhóm trong bảng tuần hoàn hóa học, giúp cho biết có bao nhiêu electron trong lớp vỏ hóa trị. Nguyên tử trở nên bền nhất khi lớp vỏ hóa trị chứa đầy các electron.
- Một số nguyên tố có cấu trúc electron bão hòa, có nghĩa là lớp ngoài cùng đã đủ electron hóa trị và không tham gia vào các phản ứng hóa học. Các nguyên tố bão hòa thường ít tương tác hóa học với các nguyên tử khác.
- Một electron hóa trị hoàn toàn có thể hấp thụ hay giải phóng năng lượng dưới dạng một photon.
- Các electron hóa trị giúp xác định độ dẫn điện của nguyên tố. Nguyên tố kim loại thường có ít electron hóa trị, khả năng dẫn điện tốt, còn phi kim thường có nhiều electron hóa trị, khả năng dẫn điện kém hoặc không dẫn điện.
Cách xác định electron hóa trị
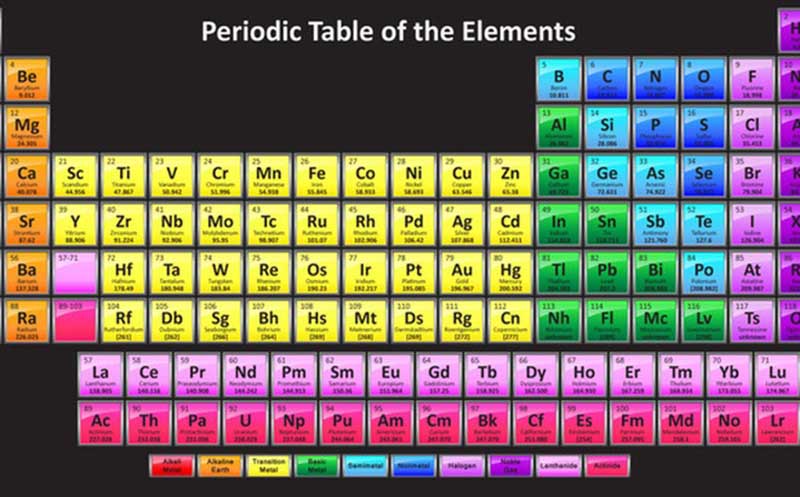
Xác định được số electron hóa trị lớp ngoài cùng của một nguyên tố hóa học là một kỹ năng cần thiết. Dựa vào đó, có thể biết số liên kết trong phân tử, cơ sở của việc phân tử đó hình thành liên kết đôi chứ không phải liên kết đơn. Dựa vào bảng HTTH các nguyên tố hóa học là cách đơn giản để xác định số electron hóa trị của nguyên tố.
Bảng hệ thống tuần hoàn của Men-đê-lê-ép được chia làm 18 cột gọi là các nhóm. Ta có nhóm IA, IIA, IIIA,… hay IB, IIB, IIIB,…
Số electron hóa trị của một nguyên tố trùng với số thứ tự của nhóm. Các nguyên tố thuộc cùng một cột thì có cùng electron hóa trị.
Các nguyên tố thuộc nhóm A thì số electron hóa trị là số electron lớp ngoài cùng của nguyên tố. Các nguyên tố thuộc nhóm B thì số electron hóa trị có thể nằm ở phân lớp ngoài cùng hoặc sát phân lớp ngoài cùng (nếu phân lớp này chưa bão hòa) của nguyên tố. Cụ thể:
- Các nguyên tố thuộc nhóm IA có 1e hóa trị
- Các nguyên tố thuộc nhóm IIA có 2e hóa trị
- Các nguyên tố thuộc nhóm IIIA có 3e hóa trị
- Các nguyên tố thuộc nhóm IVA có 4e hóa trị
- Các nguyên tố thuộc nhóm VA có 5e hóa trị
- Các nguyên tố thuộc nhóm VIA có 6e hóa trị
- Các nguyên tố thuộc nhóm VIIA có 7e hóa trị
- Các nguyên tố thuộc nhóm VIIIA có 8e hóa trị
Ví dụ: Nguyên tử của Nitơ (N) và Photpho (P) đều nằm trong nhóm VA (15) nên có tối đa 5e hóa trị, cụ thể:
- Cấu trúc electron của Nitơ (N) là: 1s² 2s² 2p³. N có 5 electron hóa trị thuộc các orbital 2s² 2p³ của lớp ngoài cùng.
- Cấu trúc electron của Photpho (P) là: 1s² 2s² 2p⁶ 3s² 3p³. P có 5 electron hóa trị thuộc các orbital 3s² 3p³ của lớp ngoài cùng.
Bảng hóa trị
Hóa trị: 1 Hóa trị: 2 Hóa trị:3 Tên Ký hiệu Tên Ký hiệu Tên Ký hiệu Sodium Na+ Magnesium Mg+2 Aluminium Al+3 Potassium K+ Calcium Ca+2 Iron (III) Fe+3 Copper (I) Cu+ Copper (II) Cu+2 Nitride N-3 Hydrogen H+ Iron (II) Fe+2 Phosphate PO4-3 Hydride H- Zinc Zn+2 Gold (III) Au+3 Chloride Cl- Oxide O-2 Titanium (III) Ti+3 Bromide Br- Sulphide S-2 Ammonium Al- Carbonate CO2-2 Hydroxide OH- Sulphite SO3-2 Nitrate NO3- Sulphate SO4-2 Oxalate CH3COO-
Lưu ý về electron hóa trị
Cần chú ý rằng số electron hóa trị hoàn toàn không giống với hóa trị của nguyên tử nguyên tố.
Hóa trị của một nguyên tử chỉ cho biết khả năng của nó trong việc tạo ra các liên kết hóa học cụ thể, tùy thuộc vào phân tử hay hợp chất mà nguyên tử đó tham gia.
Không thể xác định hóa trị chỉ dựa trên bảng tuần hoàn hóa học, mà cần phải biết cấu tạo phân tử của chất để xác định hóa trị của từng nguyên tử cấu thành chất đó.
Đôi khi, không thể biết chính xác cấu tạo phân tử của một chất, vì vậy, khái niệm “số oxy hóa” được đưa ra để xác định hóa trị giả định và tương đối của nguyên tử.
Giữa số oxy hóa của nguyên tố và số electron hóa trị của nguyên tử có mối liên hệ mật thiết. Số oxy hóa dương lớn nhất của một nguyên tố bằng số electron hóa trị của nó.

Xem thêm:
- Liên kết cộng hóa trị là gì? Chuyên đề liên kết cộng hóa trị
- Cấu hình electron nguyên tử: Quy ước cách viết và những lưu ý
- Liên kết hóa học là gì? Chuyên đề liên kết hóa học lớp 10 và Các dạng bài tập
Hy vọng qua bài viết bạn đã biết cách xác định số electron hóa trị của một nguyên tố. Nếu bạn muốn đóng góp hay còn những thắc mắc nào xoay quanh bài viết electron hóa trị là gì thì hãy để lại nhận xét bên dưới chúng mình cùng trao đổi thêm nhé!
