Hóa trị của lưu huỳnh
Lưu huỳnh hóa trị mấy được VnDoc biên soạn hướng dẫn bạn đọc trả lời, giải đáp thắc mắc về hóa trị của lưu huỳnh, S có có mấy hóa trị cũng như các hóa trị của lưu huỳnh trong hợp chất. Từ đó đưa ra các nội dung câu hỏi liên quan đến lưu huỳnh, cũng như các dạng câu hỏi bài tập liên quan. Mời các bạn tham khảo.
I. Lưu huỳnh hóa trị mấy
Lưu huỳnh có hóa trị: II, IV, VI
>> Mời các bạn tham khảo thêm hóa trị một số nguyên tố theo chương trình Hóa học mới
Tên gọi, kí hiệu Hóa học và khối lượng nguyên tử của 20 nguyên tố đầu
Số hiệu nguyên tử (Z)Tên cũTên nguyên tố hóa học (IUPAC)Kí hiệu hoá họcKhối lượng nguyên tố (amu)Hoá trị1HiđroHydrogenH1I 2 Heli Helium He 4 3LitiLithiumLi7I4BeriBerylliumBe9II5BoBoronBo11III6CacbonCarbonC12IV, II 7 Nitơ Nitrogen N 14 II, III, IV… 8 Oxi Oxygen O 16 II 9 Flo Flourine F 19 I 10 Neon Neon Ne 20 11NatriSodiumNa23I12MagieMagnesiumMg24II13NhômAluminiumAl27III 14 Silic Silicon Si 28 IV 15 Photpho Phosphorus P 31 III, V 16 Lưu huỳnh Sulfur S 32 II, IV, VI 17 Clo Chlorine Cl 35,5 I,… 18 Agon Argon Ar 39,9 19KaliPotassiumK39I20CanxiCalciumCa40II
>> Chi tiết tại liệu tại: Bảng tuần hoàn các nguyên tố Hóa học lớp 7
II. Định nghĩa lưu huỳnh
Lưu huỳnh còn có tên gọi khác là Sulfur, là một nguyên tố hoá học trong bảng tuần hoàn, có ký hiệu là S và có số nguyên tử là 16.
Nguyên tố này là một phi kim phổ biến, không mùi, không vị và có nhiều hoá trị.
Dạng gốc của phi kim này là chất rắn kết tinh màu vàng chanh.
Trong tự nhiên, phi kim này có thể tìm thấy ở dạng đơn chất hoặc trong các khoáng chất sulfua và sulfat.
Lưu huỳnh được xem là một nguyên tố thiết yếu cho sự sống và chúng được tìm thấy trong 2 axit amin. Trong thương mại, chúng được sử dụng trong phân bón hoặc dùng trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm,..
Vị trí: Ô thứ 16, chu kì 3, nhóm VIA
Kí hiệu: S
Cấu hình e: 1s22s22p63s23p4
Độ âm điện: 2,58
III. Tính chất vật lí của lưu huỳnh
1. Hai dạng thù hình của lưu huỳnh
Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
Chúng khác nhau về cấu tạo tinh thể và 1 số tính chất vật lí nhưng có tính chất hóa học giống nhau.
Chúng biến đổi qua lại với nhau theo nhiệt độ.

2. Ảnh hưởng của nhiệt độ đối với cấu tạo phân tử và tính chất vật lí của lưu huỳnh
to < 113oC, Sα và Sβ là chất rắng, màu vàng. Phân tử gồm 8 nguyên tử liên kết cộng hóa trị với nhau thành mạch vòng.
to = 119oC, S nóng chảy thành chất lòng màu vàng, linh động. S8 mạch vòng.
to = 187oC, S lỏng → quánh nhớt màu nâu đỏ.
to = 445oC, S sôi → Sn bị đứt gãy thành nhiều phân tử nhỏ bay hơi.
Ở 1700oC hơi lưu huỳnh là những nguyên tử S.
IV. Tính chất hóa học của lưu huỳnh
1. Tác dụng với kim loại và hidro
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
- Tác dụng với hiđro:
H2 + S → H2S (350oC)
- Tác dụng với kim loại (có to, tạo sản phẩm có số oxh thấp của kim loại).
Fe + S 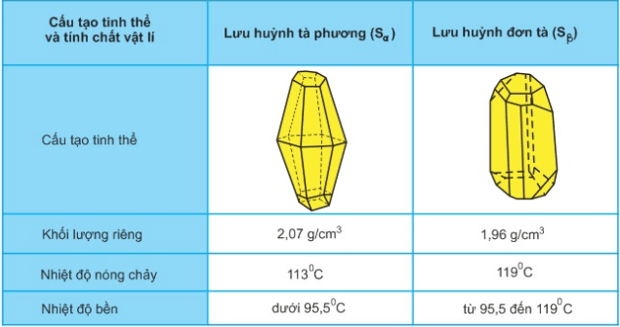 FeS
FeS
Zn + S  ZnS
ZnS
Hg + S  HgS
HgS
(Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
- Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, …
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, …
2. Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
- Tác dụng với oxi:
S + O2  SO2
SO2
S + F2  SF6
SF6
- Tác dụng với các chất có tính oxi hóa mạnh:
S + 2H2SO4 đặc  3SO2 + 2H2O
3SO2 + 2H2O
S + 4HNO3 đặc  2H2O + 4NO2 + SO2
2H2O + 4NO2 + SO2
V. Ứng dụng của lưu huỳnh
S là nguyên liệu quan trọng cho nhiều ngành công nghiệp.
Điều chế H2SO4.
Dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm, …
VI. Sản xuất lưu huỳnh
1. Khai thác lưu huỳnh
Sử dụng phương pháp Frasch để khai thác S tự do trong lòng đất.
2. Sản xuất lưu huỳnh từ hợp chất
- Đốt H2S trong điều kiện thiếu không khí.
2H2S + O2 → 2S + 2H2O
- Dùng H2S để khử SO2.
2H2S + SO2 → 3S + 2H2O
Phương pháp này giúp thu hồi trên 90% lượng S có trong các khí thải độc hại SO2 và H2S.
–
VnDoc đã gửi tới các bạn bộ tài liệu Lưu huỳnh hóa trị mấy tới các bạn. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 8, Chuyên đề Hóa học 9, Chuyên đề Hóa học 10, Chuyên đề Hóa học 11, Chuyên đề Hóa học 12 mà VnDoc tổng hợp và đăng tải.
