Chắc hẳn trong chúng ta, ai cũng đã từng nghe đến từ oxit nhưng lại rất ít người biết rõ về nó, vì oxit không được sử dụng nhiều trong cuộc sống. Vậy hôm nay, chúng ta sẽ cùng nhau tìm hiểu xem oxit là gì, một số loại oxit quan trọng và tính chất hóa học và cách gọi tên oxit nhé!
1. Định nghĩa oxit là gì?

Oxit là một hợp chất hóa học có chưa một nguyên tố là oxi
Oxit là một hợp chất hóa học có chứa hai nguyên tố trong đó có một nguyên tố là oxi.
Ví dụ: Khi ta đốt cháy P trong oxi sẽ tạo thành hợp chất (P205) là một oxit.
2. Công thức tổng quát của oxit
Công thức hóa học chung của oxit là: MxOy.
Trong đó: Gồm có ký hiệu hóa học của oxi O kèm theo chỉ số y và ký hiệu hóa học của nguyên tố M (có hóa trị n) kèm theo chỉ số x theo đúng quy tắc về hóa trị: II.y = n.x
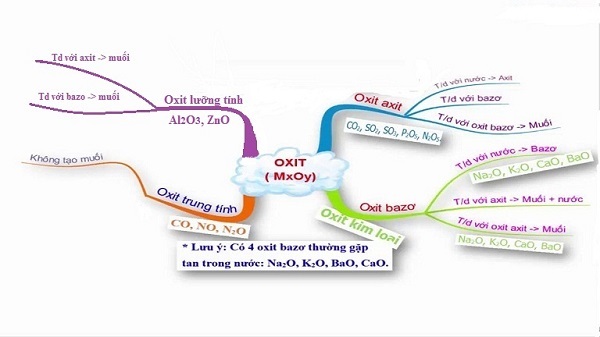
Oxit được phân thành 4 loại là oxit bazơ, oxit axit, oxit lưỡng tính, oxit trung tính.
2.1 Oxit bazơ
Oxit bazơ là hợp chất gồm một hay nhiều nguyên tử kim loại kết hợp với một hay nhiều nguyên tử oxi và có bazơ tương ứng. Các oxit bazơ tan được trong nước gồm các kim loại kiềm (Li, Na, K,…) và kim loại kiềm thổ (Mg, Ca, Ba,…) trừ Be.
Oxit bazơ tác dụng được với axit để tạo thành muối và nước. Một số oxit bazơ phản ứng với nước để tạo thành bazơ tan gọi là kiềm.
Ví dụ: Na2O – Xút vảy NaOH, Fe2O3 – Fe(OH)3…
2.2 Oxit axit
Oxit axit được gọi là anhidrit axit, là các oxit khi tác dụng với nước sẽ tạo ra axit, tác dụng với kiềm tạo thành muối hóa học. Oxit axit thường là oxit của phi kim ứng với một axit hoặc kim loại có hóa trị cao
Ví dụ: Mn2O7 – HMnO4, CO2 – H2CO3, P2O5 – H3PO4.
Oxit được phân thành 4 loại là oxit bazơ, oxit axit, oxit lưỡng tính, oxit trung tính
2.3 Oxit lưỡng tính
Là những oxit khi tác dụng với dung dịch bazơ, và khi tác dụng với dung dịch axit tạo thành muối và nước.
Ví dụ: Al2O3, ZnO.
2.4 Oxit trung tính
Oxit trung tính còn được gọi là oxit không tạo muối, là những oxit không phản ứng với axit, bazơ, nước.
Ví dụ: Cacbon monoxit – CO, Nitơ monoxit – NO,…
3. Cách gọi tên của oxit
Sau khi đã tìm hiểu xong khái niệm oxit là gì, chúng ta hãy cùng tìm hiểu cách gọi tên oxit này nhé. Hiện nay có rất nhiều cách gọi tên các loại oxit nhưng theo quy luật chúng ta vẫn có thể phân chia cách gọi tên của oxit như sau:
3.1 Tên của oxit = Tên nguyên tố + Oxit
Cách gọi này thường chỉ được áp dụng đối với kim loại, phi kim chỉ có một hoá trị duy nhất
Ví dụ:
K2O: Kali oxit
NO: Nitơ oxit
CaO: Canxi oxit
Al2O3: Nhôm oxit
Na2O: Natri oxit
3.2 Cách gọi tên của oxit kim loại có nhiều hóa trị
Tên của oxit = Tên kim loại (hóa trị) + oxit
Cách này được áp dụng khi gọi tên oxi mà trong hợp chất kim loại có nhiều hóa trị.
Ví dụ:
FeO là oxit được đọc tên “Sắt(II) Oxit
Fe2O3 là oxit được đọc tên “Sắt(III) Oxit
3.3 Cách gọi tên oxit phi kim có nhiều hóa trị
Tên oxit = Tiền tố thứ 1 (hay còn gọi là tiếp đầu ngữ) + Tên phi kim + Tiền tố thứ 2 (Tiếp đầu ngữ) + Oxit
Tiền tố: – Mono: nghĩa là 1.
– Đi : nghĩa là 2.
– Tri : nghĩa là 3
– Tetra : nghĩa là 4.
– Penta : nghĩa là 5.
Ví dụ:
SO2 : Lưu huỳnh đioxit; CO2 : Cacbon đioxit; N2O3 : Đinitơ trioxit; N2O5 : Đinitơ pentaoxit.
4. Tính chất hóa học của oxit
Tính chất hóa học của oxit
Tính chất hóa học của các loại oxit là khác nhau. Sau đây, Ghgroup.com.vn sẽ gửi đến cho các bạn tính chất hóa học của một số oxit quan trọng hiện nay.
4.1 Tính chất hóa học của oxit axit
Oxit axit tác dụng với nước: Đa số các oxit axit khi hoà tan vào nước sẽ tạo ra dung dịch axit trừ SiO2:
- Na2O + H2SO4 → Na2SO4 + H2O
- FeO + HCl → FeCl2 + H2O CuO + H2SO4 → CuSO4 + H2O
Oxit axit tác dụng với oxit bazơ tan: Oxit axit tác dụng với oxit bazơ tan sẽ tạo muối:
- SO3 + CaO -> CaSO4
- P2O5 +3Na2O -> 2Na3PO4
Oxit axit tác dụng với bazơ tan: Tuỳ vào tỷ lệ mol giữa oxit axit và bazơ phản ứng sẽ cho ra nước + muối trung hòa, muối axit hay hỗn hợp 2 muối:
– Đối với kim loại trong bazơ có hoá trị I:
Tỉ lệ mol B: OA là 1:
- NaOH +SO2 -> NaHSO3 (Phản ứng tạo muối axit)
Tỉ lệ mol B: OA là 2:
- 2KOH +SO3 -> K2SO3 +H2O (Phản ứng tạo muối trung hoà)
– Đối với kim loại trong bazơ có hoá trị II:
Tỉ lệ mol OA: B là 1:
- CO2 +Ca(OH)2 ->CaCO3 (Phản ứng tạo muối trung hoà)
Tỉ lệ mol OA: B là 2:
- SiO2 + Ba(OH)2 ->BaSiO3 (Phản ứng tạo muối axit)
Đối với axit có gốc axit hoá trị III:
Tỉ lệ mol B: OA là 6:
- P2O5 +6NaOH ->2Na2HPO4 +H2O
Tỉ lệ mol B: OA là 4:
- P2O5 +4NaOH ->2NaH2PO4 +H2O
Tỉ lệ mol B: OA là 2:
4.2 Tính chất hóa học của oxit bazơ
Oxit bazơ tác dụng với nước: Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ là tác dụng với nước. Cụ thể là 4 oxit sau: Na2O, CaO, K2O, BaO.
Ví dụ:
- CaO(r) + H2O → Ca(OH)2 (dd)
- BaO(r) + H2O → Ba(OH)2 (dd)
Oxit bazơ tác dụng với axit: Đa số các oxit bazơ tác dụng với axit tạo thành muối và nước.
Cách viết: oxit bazơ + Axit -> muối + H2O
- CuO(r) + 2HCl(dd) → CuCl2(dd) + H2O (lỏng)
Oxit bazơ tác dụng với oxit axit: Chỉ một số oxit bazơ tác dụng với oxit axit tạo thành muối.Thông thường đó là các oxit axit tác dụng được với nước (Na2O, CaO, K2O, BaO).
Cách viết: oxit bazơ + oxit axit -> muối
- BaO(r) + CO2 (k) → BaCO3(r)
5. Một số dạng bài tập liên quan tới oxit
Một số dạng bài tập liên quan tới oxit thường xuất hiện nhiều trong đề kiểm tra, đề thi không chỉ ở cấp THCS mà còn cả ở cấp THPT. Vì vậy Ghgroup.com.vn xin chia sẻ cách giải một số dạng bài tập liên quan đến oxit, nhằm giúp các bạn hoàn thiện, nâng cao kiến thức để hoàn thành bài thi chính xác nhất.
5.1 Bài tập oxit axit tác dụng với bazơ
Trường hợp 1: Khi các oxit axit (CO2, SO2…) tác dụng với dung dịch kiềm (KOH, NaOH…)
- Phương trình hóa học
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
- Cách giải
Bước 1: Xét tỷ lệ mol bazơ và oxit axit, giả sử là T
– Nếu T ≤ 1: Sản phẩm thu được là muối axit tức chỉ xảy ra phản ứng (1)
– Nếu 1 < T < 2: Sản phẩm thu được là muối axit và muối trung hòa tức xảy ra đồng thời 2 phản ứng (1) và (2)
– Nếu T ≥ 2: Sản phẩm thu được là muối trung hòa tức chỉ xảy ra phản ứng (2).
Bước 2: Viết phương trình phản ứng và tính toán theo phương trình đó (nếu xảy ra cả 2 phản ứng thì cần đặt ẩn và giải theo hệ phương trình)
Bước 3: Từ phương trình hóa học kết hợp áp dụng các định luật như định luật bảo toàn khối lượng, bảo toàn nguyên tố để giải đáp các yêu cầu đề bài đưa ra
Trường hợp 2: Khi các oxit axit (CO2, SO2…) tác dụng với dung dịch kiềm thổ (Ca(OH)2, Ba(OH)2…)
- Phương trình phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
- Cách giải
Bước 1: Xét tỉ lệ
– Nếu T ≤ 1: Sản phẩm thu được là muối trung hòa (xảy ra phản ứng (1))
– Nếu 1 < T < 2: Sản phẩm thu được là muối axit và muối trung hòa (xảy ra phản ứng (1) và (2))
– Nếu T ≥ 2: Sản phẩm thu được là muối axit (xảy ra phản ứng (2)).
Bước 2 và bước 3 tương tự trường hợp 1.
5.2 Một số dạng bài tập khác
- Bài toán về oxit bazơ tác dụng với dung dịch axit
Để làm được dạng bài tập này, các em cần áp dụng theo các bước như sau:
+ Viết phương trình
+ Xác định số mol lượng chất đề bài cho sẵn
+ Từ phương trình hóa học, áp dụng thêm một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của đề bài.
Ví dụ: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là
Hướng dẫn giải chi tiết:
nMgO = 0,25 mol
MgO + 2HCl → MgCl2 + H2O
0,25 → 0,5 mol
=> Nồng độ của dung dịch HCl là
CM=nV=0,50,4=1,25M
- Bài tập phản ứng giữa các oxit, nước
Ví dụ: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là:
Hướng dẫn giải chi tiết:
Phương trình phản ứng: Na2O + SO2 → Na2SO3
nNa2O = nSO2=3,36:22,4=0,15(mol)
%mNa2O=0,15.62/20×100%=46,5%
⇒ %mCuO=53,5%
(Lưu ý CuO không phản ứng được với SO2)
Trên đây là những thông tin về oxit mà Ghgroup.com.vn đã chia sẻ đến các bạn. Hy vọng, thông qua bài viết trên các bạn đã biết được oxit là gì? Cách gọi cũng như các tính hóa học cơ bản của oxit. Và một số dạng bài tập về oxit. Nếu bạn vẫn còn thắc mắc nào về oxit hay bất kỳ hoá chất nào thì đừng ngần ngại liên hệ với chúng tôi qua số Hotline 0916047878 – 0974.245.670 để được giải đáp nhé!
