Ở trạng thái kim loại sắt rất tốt trong vỏ Trái Đất, bị giới hạn bởi sự lắng đọng của thiên thạch. Bề mặt sắt mới tạo ra xuất hiện màu xám bạc bóng loáng, nhưng sẽ oxy hóa trong không khí bình thường để tạo ra các oxide sắt ngậm nước màu nâu đến đen, thông thường được gọi là gỉ sắt. Để hiểu rõ được nguyên tố Sắt ( Fe ) hóa trị mấy? Sắt là gì? Nguyên tử khối của Fe thì chúng ta cùng nhau tìm hiểu nhé.
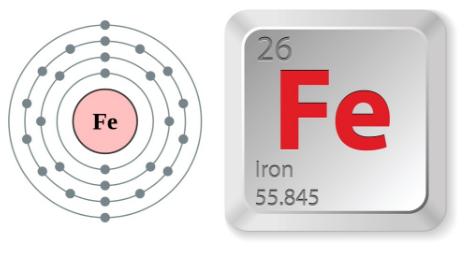
Sắt là tên một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Fe và số hiệu nguyên tử bằng 26. Sắt là nguyên tố có nhiều trên Trái Đất, cấu thành lớp vỏ ngoài và trong của lõi Trái Đất .
Sắt là sắt kẽm kim loại màu trắng hơi xám, dẻo, dai, dễ rèn, nhiệt độ nóng chảy khá cao 1540 ºC. Sắt Dẫn nhiệt, dẫn điện tốt, có tính nhiễm từ .
Fe hóa trị mấy? Nguyên tử khối của Fe
Trong bảng tuần hoàn nguyên tố hóa học thì sắt có :
- Crom ( Cr ) hóa trị mấy? Nguyên tử khối của Cr? M của Cr là bao nhiêu?
- Muối photphat ( PO4 ) hóa trị mấy? PO4 là gì? Tính chất của PO4
- Đặc điểm, Tính chất hóa học của Đồng ( Cu )? Đồng ( Cu ) hóa trị mấy?
Sắt có kí hiệu: Fe Cấu hình electron: 1s22s22p63s23p63d64s2 hoặc [Ar]3d64s2 Số hiệu nguyên tử: 26 Nguyên tử khối: 56 Hóa trị của Fe : II, III Số proton : 26 Nhóm: VIIIB Sắt chu kì: 4 Đồng vị: sắt có nhiều đồng vị như 55Fe, 56Fe, 58Fe, 59Fe Độ âm điện là : 1,83
Tính chất vật lí:
– Sắt là kim loại màu trắng hơi xám, dẻo, dai, dễ rèn, nhiệt độ nóng chảy khá cao( 1540oC) – Dẫn nhiệt, dẫn điện tốt, có tính nhiễm từ.

Tính chất hóa học của Sắt:
Sắt có đầy đủ tính chất hóa học đặc trưng của kim loại như sau:
Fe tác dụng với phi kim
Fe tác dụng với O2
Sắt công dụng với oxi tạo thành oxit sắt từ, trong đó Fe có hóa trị ( II ) và ( III ) . 3F e + 2O2 ( t ° ) → Fe3O4
Fe Tác dụng với các phi kim khác
Sắt công dụng với 1 số ít phi kim tạo thành muối . 2F e + 3C l2 ( t ° ) → 2F eCl3 Fe + S ( t ° ) → FeS 2F e + 3B r2 ( t ° ) → 2F eBr3
Fe tác dụng với dung dịch axit Sắt tính năng với một số ít dd axit ( HCl, H2SO4 loãng … ) tạo thành muối sắt ( II ) và giải phóng khí H2 . Fe + 2HC l → FeCl2 + H2 ↑ Fe + H2SO4 loãng → FeSO4 + H2 ↑ Fe không tính năng với H2SO4 đặc, nguội và HNO3 đặc, nguội .
Fe tác dụng với dung dịch muối
Sắt công dụng với dung dịch muối của những sắt kẽm kim loại có hoạt động hóa học yếu hơn ( như Cu, Ag, Pb … ) tạo ra muối Sắt và sắt kẽm kim loại mới . Fe + CuSO4 → FeSO4 + Cu ↓ Fe + 2A gNO3 → Fe ( NO3 ) 2 + 2A g ↓ Fe + Pb ( NO3 ) 2 → Fe ( NO3 ) 2 + Pb ↓
Trạng thái tự nhiên và điều chế:
– Sắt thuộc các nguyên tố phổ biến nhất cấu tạo nên vỏ quả đất. Khoáng vật chủ yếu của Sắt là manhetit (Fe3O4), hemantit đỏ (Fe2O3), hemantit nâu [Fe2O3.2Fe(OH)3].

– Sắt tinh khiết được điều chế bằng cách dùng H2 tinh khiết để khử oxit sắt.
Fe2O3 + 3 H2 à 2Fe + 3 H2O
Xem thêm bảng hóa trị và hóa trị của các nguyên tố:
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
Amoni NH4 là gì? NH4 hóa trị mấy? NH4 là ion gì?
Kim loại kiềm hóa trị mấy? Kim loại kiềm gồm những nguyên tố nào?
SO2 hóa trị mấy? Cấu tạo phân tử của khí SO2
Chì ( Pb ) hóa trị mấy? Khối lượng mol của pb
