Cacbon (C) hóa trị mấy, có các tính chất vật lý, hóa học và có ứng dụng gì? Đây những thông tin mà nhiều người tìm hiểu? Hãy cùng theo dõi bài viết dưới đây để có được những thông tin hữu ích nhé.

Cacbon (C) hóa trị mấy?
Câu hỏi: Cacbon có hóa trị bao nhiêu?
Trả lời: Cacbon có 2 hóa trị là IV và II. Trong đó, hóa trị IV được biết đến phổ biến nhất.
Các thông tin khác về Cacbon
- Ký hiệu hóa học: C
- Nguyên tử khối: 12
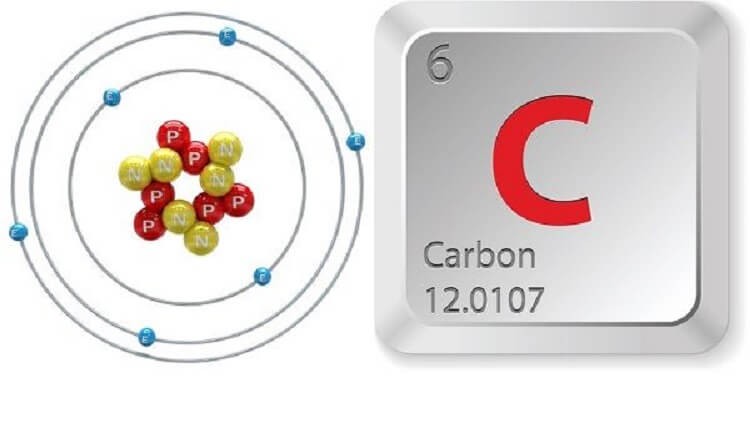
- Số hiệu nguyên tử: z = 6 thuộc chu kỳ 2, nhóm IVA
- Cấu hình electron: 1s22s22p2
- Các số oxi hóa của C là: -4, 0, +2, +4
Tính chất vật lý của Cacbon
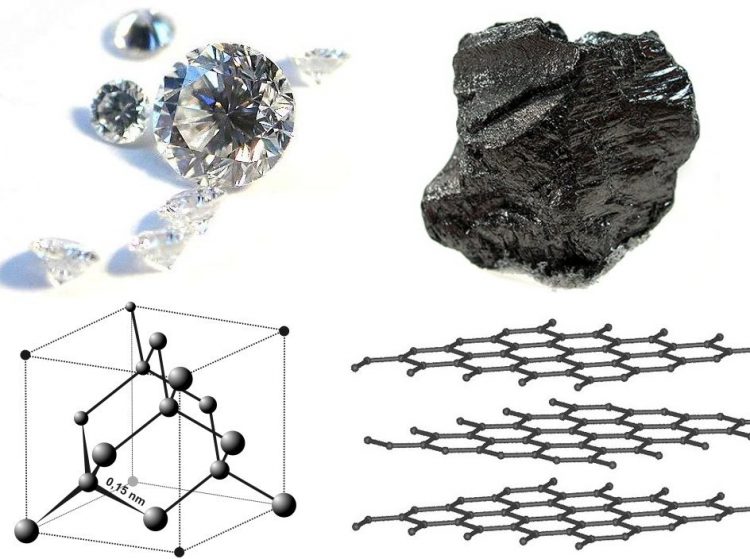
Cacbon tồn tại ở những dạng thù hình khác nhau thư than chì, kim cương, fuleren và cacbon vô định hình.
Than chì
Than chì có màu xám đen và ánh kim, cấu trúc lớp nên mềm. Khi vạch lên giấy sẽ để lại vạch đen với nhiều lớp tinh thể.
Than chì có khả năng dẫn điện tốt nhưng kém hơn kim loại.
Kim cương
Kim cương có cấu trúc tinh thể nguyên tử và rất cứng. Kim cương trong suốt, dẫn nhiệt kém và không dẫn điện.
Fuleren
Fuleren bao gồm các phân tử C60, C70. Trong đó, phân tử C60 có cấu trúc cầu rỗng 32 mặt với 60 đỉnh là 60 nguyên tử cacbon.
Cacbon vô định hình
Các loại than được đốt từ gỗ, than muội, than xương,… được gọi là cacbon vô định hình. Cacbon vô định hình có cấu tạo xốp nên có thể hấp thụ các chất khí và chất tan trong dung dịch.
Tính chất hóa học của Cacbon
Cacbon là một phi kim hoạt động yếu với tính chất hóa học nổi bật nhất là tính khử. Các tính chất hóa học của cacbon:
Tác dụng với oxi
Cacbon cháy trong tạo thành cacbon đioxit, phản ứng tạo nhiều nhiệt. Trong phản ứng này, cacbon đóng vai trò là chất khử.
Phương trình hóa học:
C + O2 → CO2
Tác dụng với oxit kim loại
Cacbon có thể khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
Phương trình hóa học:
CuO + C → Cu + CO
Tác dụng với các chất oxi hóa mạnh
Khi phản ứng với các chất oxi hóa mạnh như H2SO4 đặc, HNO3,… thì C sẽ được đẩy lên số oxi hóa cao nhất +4.
Phương trình hóa học:
CO2 + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O
Tác dụng với hidro
Khi phản ứng với hidro, Cacbon thể hiện tính oxi hóa. Phản ứng xảy ra ở nhiệt độ cao
C + 2H2 → CH4
Tác dụng với kim loại tạo thành cacbua
Trong phản ứng này, C tiếp tục thể hiện tính oxi hóa khi nhận thêm electron.
C + Al → Al4C3
Cách điều chế cacbon
Bên cạnh việc khai thác từ tự nhiên thì mỗi dạng thù hình của cacbon lại có cách điều chế khác nhau. Dưới đây là các cách điều chế phổ biến.
- Điều chế kim cương nhân tạo: Nung than chì ở trong điều kiện nhiệt độ khoảng 2.000 độ C, áp suất 50 đến 100 nghìn atmotphe cùng chất xúc tác sắt, niken hoặc crom.
- Làm than cốc: Nung than trong lò luyện cốc ở nhiệt độ cao khoảng 2.000 độ C. Quá trình nung sẽ làm bay hơi hoặc phân hủy các chất hữu cơ có trong than, tạo ra các sản phẩm dễ bay hơi, trong đó có cả nước, tồn tại dạng khí than và nhựa than đá. Than cốc chính là sản phẩm không bay hơi của quá trình phân hủy, cặn cacbon và khoáng chất kết dính với nhau của các hạt than ban đầu dạng chất rắn, cứng và hơi thủy tinh.
- Điều chế than chì: Nung than cốc trong nhiệt độ trong khoảng 2.500 – 3.000 độ C trong lò điện với điều kiện không có không khí.
- Than gỗ: Thực hiện đốt gỗ trong điều kiện thiếu không khí để tạo thành than gỗ.
Các ứng dụng của cacbon
Mỗi dạng thù hình của cacbon lại có những ứng dụng khác nhau, cụ thể là:
- Kim cương được dùng làm đồ trang sức có giá trị cao. Bên cạnh đó, kim cương còn được dùng để chế tạo mũi khoan, bột mài, dao cắt thủy tinh bởi đặc tính rất cứng của chúng.
- Than chì được ứng dụng rất nhiều trong ngành sản xuất thép, các vật liệu composite, các loại vật liệu chịu lửa. Than chì cũng được dùng để chế tạo các điện cực của đèn hồ quang, acquy, pin, chất bôi trơn…
- Than hoạt tính được sử dụng để làm mặt nạ phòng độc, khử mùi, khử màu.
- Than gỗ ứng dụng trong sản xuất thuốc nổ, thuốc pháo
- Than muội dùng để sản xuất xi đánh giày, mực in, chất độn cao su,…

Bài tập vận dụng
Bài 1. Vì sao than chì và kim cương là 2 dạng thù hình của cacbon?
A. Kim cương và than chì cùng có cấu tạo mạng tinh thể giống nhau
B. Kim cương và than chì có tính chất vật lý tương tự nhau
C. Kim cương và than chì đều cấu tạo từ nguyên tố cacbon
D. Kim cương và than chì có màu sắc giống nhau
Đáp án: C.
Bài 2. Vì sao kim cương cứng nhất trong tự nhiên, than chì lại mềm?
A. Kim cương có cấu trúc tinh thể nguyên tử dạng tứ diện đều còn than chì có cấu trúc lớp và có khoảng cách giữa các lớp khá lớn
B. Kim cương là cacbon nhân tạo có kiểu liên kết cộng hóa trị bền vững
C. Than chì có các electron tự do
D. Do một số nguyên nhân khác
Đáp án A.
Bài 3. Phản ứng nào dưới đây là sai?
A. 2C + O2 → 2CO
B. 3C + 2KClO3 → 3CO2 + 2KCl
C. CaO + 4C → CaC2 + 2CO
D. C + MgO → CO2 + Mg
Đáp án: D.
Lời giải: Khi cho C tác dụng với MgO sẽ thu được CO và Mg theo phản ứng sau:
C + MgO → CO + Mg (điều kiện phản ứng ở nhiệt độ 2000 độ C)
Bài 4: Phản ứng nào thể hiện tính khử của cacbon?
A. 3C + 4Al → Al4C3
B. C + 2H2 → CH4
C. C + 2CuO → Cu + CO2
D. Không có phản ứng nào
Đáp án: C.
C → C+4 + 4e
Bài 5: Trong các phản ứng hóa học, nhận định nào đúng về cacbon?
A. Cacbon chỉ thể hiện tính khử
B. Cacbon chỉ thể hiện được tính oxi hóa
C. Cacbon không thể hiện được cả tính khử lẫn tính oxi hóa
D. Cacbon có cả tính khử và tính oxi hóa
Đáp án: D.
Trong các phản ứng hóa học cacbon thể hiện cả tính oxi hóa và tính khử. Tuy nhiên, tính khử sẽ nổi bật hơn.
Bài 6: Đốt 2,4 gam than đá (chứa 5% tạp chất) trong oxi dư, thu được V lít khí cacbonic ở đktc. Giá trị của V là bao nhiêu?:
A. 4,48 lít
B. 4,256 lít
C. 0,224 lít
D. 4,71 lít
Đáp án B.
Lời giải:
Phương trình hóa học:
C + O2 → CO2
Số mol Than đá: nCaCO3 = 2.412x 0.95 = 0.19 mol
Từ phương trình phản ứng ta có: nCO2 = nC = 0.19 mol
Vậy thể tích khí CO2 là: V = 0,19. 22,4 = 4,256 lít
Bài 7: Nhận định nào sau đây là sai?
A. Cacbon monoxit là một chất khử mạnh và không tạo ra muối.
B. Ở nhiệt độ cao cacbon có thể khử được tất cả các oxit kim loại và làm giải phóng kim loại.
C. Than gỗ được dùng để chế thuốc súng, thuốc pháo, chất hấp phụ.
D. Than muội được dùng trong sản xuất mực in, làm chất độn cao su và xi đánh giày.
Đáp án: B
Ở nhiệt độ cao cacbon có thể khử được một số oxit kim loại đứng sau Al như PbO, ZnO,… thành kim loại Pb, Zn,…
Bài 8: Phản ứng nào trong các phản ứng dưới đây thể hiện tính oxi hóa của cacbon?
A. C + O2 → CO2
B. C + 2CuO → 2Cu + CO2
C. 3C + 4Al → Al4C3
D. C + H2O → CO + H2
Đáp án C.
Bài 10: Đốt cháy hoàn toàn m gam than (C) bằng V lít oxi thu được 2,24 lít hỗn hợp khí X gồm 2 khí. X có tỉ khối với oxi bằng 1,25. Các thể tích khí đo được đều ở đktc. Giá trị của m là bao nhiêu?
A. 1,2 và 1,96.
B. 1,5 và 1,792.
C. 1,2 và 2,016.
D. 1,5 và 2,8.
Đáp án A.
Lời giải:
Phương trình hóa học:
C + O2 → CO + CO2
Gọi số mol CO là x mol
Gọi số mol CO2 là y mol
x + y = 0,1 ⇒ nC = 0,1 ⇒ m = 1,2 gam
28x + 44y = 32. 1,25(x + y) ⇒ x = 0,025; y = 0,075 (mol)
Theo định luật bảo toàn nguyên tố O:
nO2 = 0,0875 mol
Bài 10: Tính chất nào của than hoạt tính để chế tạo ra mặt nạ phòng độc và các thiết bị lọc nước?
A. Than hoạt tính dễ cháy.
B. Than hoạt tính có thể hấp phụ mạnh.
C. Than hoạt tính có cấu trúc lớp.
D. Than hoạt tính có khả năng có thể hòa tan tốt trong nhiều loại dung môi.
Đáp án B.
Trên đây là những đáp án câu hỏi “Cacbon hóa trị mấy” và các thông tin liên quan. Mong rằng sẽ giúp bạn có được nhiều kiến thức bổ ích về nguyên tố C.
