Định nghĩa axit cacbonic là gì?
Axit cacbonic là một hợp chất vô cơ có công thức hóa học là H2CO3. Đôi khi, nó còn được gọi là dung dịch carbon dioxide trong nước, vì có chứa một lượng nhỏ H2CO3. Axit cacbonic tạo thành hai loại muối là carbonat và bicarbonat.
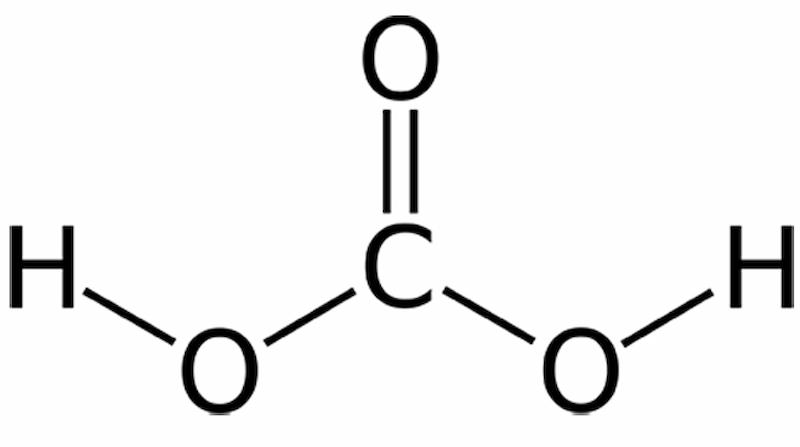
Công thức hóa học của axit cacbonic là: H2C03
Khối lượng phân tử: 62,03 g/mol
Axit cacbonic được các nhà khoa học biết đến lần đầu tiên trong nước khoáng vì vị chua. Năm 1597, Andreas Libavius đã công bố trong luận án của ông về axit cacbonic. Johan Baptista van Helmont đã tường thuật chi tiết về quá trình lên men và tác dụng của axit khoáng sản trên đá cacbon.
Axit cacbonic được hình thành bởi carbon dioxide và nước. Axit cacbonic chỉ xảy ra thông qua muối (cacbonat), muối axit (hydro cacbonat), amin (axit carbamic) và axit clorua (carbonyl clorua) (MeSH, 1991).
Trạng thái tự nhiên và tính chất vật lý của axit cacbonic
Axit cacbonic được tìm thấy trong đá và hang động, trong than đá, thiên thạch, núi lửa, mưa axit, nước ngầm, đại dương, biển, hồ, sông và thực vật. H2CO3 còn được tìm thấy trong cơ thể con người. Khí CO2 có trong máu kết hợp với nước tạo thành axit cacbonic, sau đó được thở ra dưới dạng khí của phổi. Ngày nay, axit cacbonic cũng được dùng trong nhiều loại nước uống, như cola.

Khi thực hiện phản ứng cho khí CO2 tan trong lượng nước vừa đủ với công thức V(CO2)/ V(H2O) = 9/100, người ta quan sát thấy hiện tượng: Khi trời mưa, nước tạo ra sẽ tự động tác dụng với không khí có sẵn và hòa tan tạo ra khí CO2. Lần lượt cho một lượng nước để trung hòa một lượng khí CO2 với tỷ lệ nước/khí là 10/9. Thống kê từ các cuộc thí nghiệm này cho thấy, cứ một phân khối khí sẽ cho ra một ml dung dịch H2CO3. Quá trình này được đẩy nhanh hơn khi ta nung nóng dung dịch trong quá trình xảy ra phản ứng.
Như vậy, ta có kết luận rằng: Khi trời mưa, một lượng H2CO3 đã được tạo ra và có lẫn trong không khí.
- Khí CO2 hòa tan trong nước mưa và nước tự nhiên: Khoảng 1000 cm3 khí CO2 hòa tan được 90 cm3 khi CO2.
- Một phần khí CO2 tác dụng với nước tạo thành axit cacbonic, phần lớn khí CO2 còn lại vẫn tồn tại trong khí quyển.
- Axit cacbonic chỉ tồn tại trong dung dịch nước, nó không thể cô lập các hợp chất tinh khiết.
Tính chất hóa học của axit cacbonic
Axit cacbonic (H2CO3) mang đặc tính của một axit nhưng ở dạng rất yếu, nên khiến quỳ tím chuyển màu đỏ nhạt.
H2CO3 là một axit không bền, khó tồn tại trong không khí. Trong điều kiện thường, axit cacbonic tạo thành trong các phản ứng hóa học lập tức bị phân hủy ngay thành CO2 và nước theo phương trình: H2CO3 → CO2 + H2O

Là một axit lưỡng cực, axit cacbonic có thể tạo thành hai loại muối, cacbonat và bicacbonat. Việc bổ sung bazơ vào một lượng dư axit cacbonic sẽ tạo ra muối bicarbonate, trong khi việc bổ sung bazơ dư thừa vào axit cacbonic sẽ tạo ra muối cacbonat (Theo Trung tâm Thông tin Công nghệ sinh học Quốc gia, 2017).
Axit cacbonic là một chất không được coi là độc hại hoặc nguy hiểm. Tuy nhiên, nếu tiếp xúc với nồng độ cao có thể gây kích ứng mắt và đường hô hấp.
Điều chế axit cacbonic như thế nào?
Axit cacbonic là một axit rất yếu và nó gần như không tồn tại được lâu.
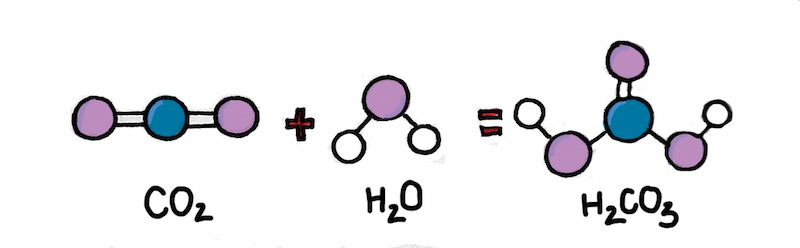
Người ta điều chế axit cacbonic bằng cách cho CO2 phản ứng với nước theo phương trình sau:
H2O + CO2 → H2CO3
Xem thêm:
- Cacbon oxit (CO) là gì? Tính chất và các ứng dụng phổ biến
- Cacbon dioxit (CO2) là gì? Tính chất, cách điều chế, ứng dụng và bài tập chi tiết
Ứng dụng axit cacbonic trong tự nhiên và đời sống
Với những tính chất vật lý và hóa học của mình, axit cacbonic có ứng dụng như thế nào trong tự nhiên và đời sống?

- Trong tự nhiên, H2CO3 có thể hòa tan đá vôi, dẫn đến sự hình thành của canxi bicacbonat Ca(HCO3)2. Đây chính là lý do tạo nên nhiều đặc điểm của đá vôi như măng đá và nhũ đá.
- Trong đời sống, axit cacbonic (H2CO3) cũng được sử dụng trong nhiều loại nước uống có gas như cola.
- Axit cacbonic còn được tìm thấy trong thực phẩm lên men dưới dạng chất thải được tạo ra bởi vi khuẩn ăn thức ăn (Theo Michelle McGuire trong Khoa học dinh dưỡng). Ví dụ về các loại thực phẩm lên men thường ăn là nước tương, súp miso, dưa cải, kim chi và sữa chua. Các loại thực phẩm này chứa vi khuẩn có lợi có thể kiểm soát các vi sinh vật có khả năng gây bệnh đường ruột và cải thiện việc sản xuất vitamin B12 và K.
- Axit cacbonic đóng vai trò trong tính axit cao của soda, nhưng hàm lượng đường tinh luyện và axit photphoric là nguyên nhân chính gây ra tính axit nói trên.
- Ngoài ra, H2CO3 cũng được sử dụng trong nhiều lĩnh vực khác như dược phẩm, mỹ phẩm, phân bón, chế biến thực phẩm, thuốc gây mê, v.v..
Bài tập về axit cacbonic SGK Hóa học 9 kèm lời giải
Như vậy, chúng ta đã nắm rõ những kiến thức cơ bản về axit cacbonic. Cùng vận dụng kiến thức đã học ở trên để thực hành bài tập sau:

Bài tập về axit cacbonic (trang 91 SGK Hóa 9)
Hãy lấy ví dụ chứng tỏ rằng H2CO3 là axit yếu hơn HCl và là axit không bền.
Lời giải:
Axit HCl tác dụng với muối cacbonat tạo thành axit cacbonic.
2HCl + Na2CO3 → 2NaCl + H2CO3
H2CO3 là axit không bền, bị phân hủy ngay cho CO2 và H2O nên phương trình được viết là:
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O.
XÂY DỰNG NỀN TẢNG TOÁN HỌC VỮNG CHẮC CHO TRẺ TỪ NHỎ VỚI ĐA PHƯƠNG PHÁP DẠY HỌC TÍCH CỰC, CHI PHÍ CỰC RẺ CHƯA ĐẾN 2K/NGÀY CÙNG MONKEY MATH.

Bài tập Axit Cacbonic tự luyện
Ngoài những bài tập trong SGK, dưới đây sẽ là một số bài tập liên quan để các em vận dụng lý thuyết và cùng nhau thực hành:
Câu 1: Dãy các chất nào sau đây là muối axit ?
A. NaHCO3, BaCO3, Na2CO3.
B. Ba(HCO3)2, NaHCO3, Ca(HCO3)2.
C. Ca(HCO3)2, Ba(HCO3)2, MgCO3.
D. Mg(HCO3)2, Ba(HCO3)2, CaCO3.
Đáp án: B
Câu 2: Dãy gồm các muối đều tan trong nước là
A. CaCO3, MgCO3, Mg(HCO3)2, K2CO3.
B. CaCO3, NaHCO3, Mg(HCO3)2, Na2CO3.
C. CaCO3, Na2CO3, NaHCO3, MgCO3.
D. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Đáp án: D
Câu 3: Dãy gồm các chất bị phân hủy bởi nhiệt là
A. Na2CO3, Mg(OH)2, Ca(HCO3)2, BaCO3.
B. MgCO3, BaCO3, Ca(HCO3)2, NaHCO3.
C. K2CO3, KOH, MgCO3, Ca(HCO3)2.
D. NaHCO3, KHCO3, Na2CO3, K2CO3.
Đáp án: B
Câu 4: Dãy gồm các chất đều phản ứng với dung dịch HCl ở điều kiện thường là
A. Na2CO3, CaCO3.
B. K2SO4, Na2CO3.
C. Na2SO4, Mg(NO3)2.
D. Na2SO3, KNO3.
Đáp án: A
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
Câu 5: Cặp chất nào sau đây có thể cùng tồn tại trong dung dịch ?
A. HCl và KHCO3.
B. Ca(OH)2 và Ca(HCO3)2.
C. K2CO3 và CaCl2.
D. K2CO3 và Na2SO4.
Đáp án: D
Dung dịch K2CO3 không phản ứng với dung dịch Na2SO4.
Câu 6: Cho 4 gam CaCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là:
A. 0,05 lít.
B. 0,04 lít.
C. 0,75 lít.
D. 0,15 lít.
Đáp án: B
Câu 7: Cho phương trình hóa học sau: X + NaOH → Na2CO3 + H2O. X là
A. C.
B. NaHCO3.
C. CO.
D. KHCO3.
Đáp án: B
NaHCO3 + NaOH → Na2CO3 + H2O
Câu 8: Khối lượng kết tủa tạo ra, khi cho 10,6 gam Na2CO3 tác dụng vừa đủ với dung dịch Ca(OH)2 là
A. 5 gam.
B. 10 gam.
C. 15 gam.
D. 20 gam.
Đáp án: B
Câu 9: Có 2 dung dịch K2SO4 và K2CO3 thuốc thử nào sau đây có thể nhận biết 2 dung dịch trên ?
A. Dung dịch BaCl2.
B. Dung dịch HCl.
C. Dung dịch NaOH.
D. Dung dịch Pb(NO3)2.
Đáp án: B
Câu 10: Nung hoàn toàn hỗn hợp 2 muối CaCO3 và MgCO3 thu được 76 gam hai oxit và 33,6 lít CO2 (đktc). Khối lượng hỗn hợp muối ban đầu là
A. 142 gam.
B. 124 gam.
C. 141 gam.
D. 140 gam.
Đáp án: A
Bài viết trên đây đã cung cấp cho bạn đầy đủ những kiến thức quan trọng như định nghĩa, tính chất và ứng dụng của axit cacbonic (H2CO3) – một hợp chất vô cơ cực kỳ phổ biến trong đời sống. Hy vọng những kiến thức này sẽ có ích cho quá trình học tập của bạn. Hãy chia sẻ nếu thấy bài viết hữu ích và đừng quên truy cập website của Monkey hàng ngày để tham khảo thêm nhiều thông tin thú vị khác về môn Hóa học.
